|
|
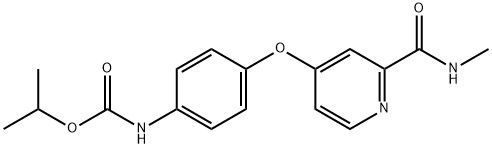
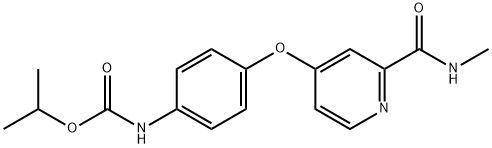
95+ Polvo blanco Sorafenib Impuridad D CAS 2206827-14-5
|
Datos del producto:
Pago y Envío Términos:
|
| Nombre del producto: | Sorafenib Impuridad D | No CAS: | Se trata de un artículo de la Directiva 89/391/CEE. |
|---|---|---|---|
| ¿ Qué pasa?: | 329.35 | En el caso de las empresas: | C17H19N3O4 |
| Apariencia: | Polvo blanco | Purificación: | 95+ |
| EINECS No: | - | Almacenamiento: | Entre 5 y 25°C |
Descripción del producto
Sorafenib en polvo blanco Impuridad D CAS 2206827-14-5 95+
Nombre:Regorafenib Impuridad D
CAS NO:Se trata de un artículo de la Directiva 89/391/CEE.
¿ Qué pasa?- ¿Qué es eso?35
Apariencia: Polvo blanco
Purificación: Más de 95 años
Sinónimos:Regorafenib Impuridad D
Aplicación
Regorafenib Impuridad D es una impureza específica presente en Regorafenib, un fármaco utilizado principalmente en el tratamiento de ciertos tipos de cáncer como inhibidor de la multicinasa.cuando se trata de la aplicación de Regorafenib Impuridad D, no sirve como principio activo con fines terapéuticos.
De hecho, las impurezas en los medicamentos son factores que requieren un estricto control durante la fabricación farmacéutica para garantizar la seguridad y eficacia del medicamento.Las altas concentraciones de impurezas pueden afectar la purezaEn el caso de los medicamentos, la determinación de la eficacia, la estabilidad y la actividad biológica del fármaco, lo que conduce a efectos adversos o a una reducción de los beneficios terapéuticos.El control de las impurezas es un paso crucial en el desarrollo y producción de medicamentos..
El estudio de Regorafenib Impuridad D se centra en comprender sus propiedades químicas, sus posibles actividades biológicas y los mecanismos de su formación durante la producción y almacenamiento de fármacos.Haciendo una investigación profunda sobre esta impureza, las empresas farmacéuticas pueden optimizar sus procesos de fabricación, reducir los niveles de impurezas y, en última instancia, mejorar la calidad y la seguridad del producto final.
Paquete
![]()
![]()
![]()
![]()
Transporte
Los paquetes pequeños ((1g, 25g, 1Kg, 25Kg) pueden enviarse por Express. (DHL, FedEx, EMS, etc.)
Los paquetes grandes ((100kg y más de100Kg) se pueden transportar por aire o mar.
Todo el transporte está de acuerdo con las necesidades del cliente.
Perfil de la empresa
![]()
![]()
![]()
![]()
![]()
![]()
Persona de Contacto: admin
-
98+ Impuridades de polvo blanco ((Estándares) 6-Chloro-N-Metilpiridina-2-Carboxamida CAS 845306-04-9
-
98+ Polvo blanco TICAGRELOR CAS 1129683-88-0 C14H14N4O3
-
98+ Impuridades de polvo blanco ((Estándares) Sorafenib Impuridad 16 CAS 2206827-12-3
-
Compuesto relacionado con el sorafenib 98+ Polvo blanco 8 NO. 1431697-81-2 CAS
-
98+ Polvo blanco Sorafenib impureza 6 CAS 1285533-84-7
-
Sorafenib en polvo blanco puro 98+ Impuridad 3 CAS NO. 284670-98-0 C27H24N6O5